2024年11月27日,华中师范大学朱成周教授团队在Nature Communications期刊发表题为“Pd hydride metallene aerogels with lattice hydrogen participation for efficient hydrogen evolution reaction”的研究论文,团队成员汪恒佳为论文第一作者,朱成周教授为论文通讯作者。
全文速览
基于传统析氢反应(HER)机制,单相催化剂中的氢吸附和解吸通常发生在单个催化位点,这使得难以突破Sabatier原理的限制。本研究中,我们合成了β-Pd氢化物金属烯(β-PdHene)气凝胶,作为一种先进的HER催化剂。与传统反应路径相比,晶格氢参与机制可以分离吸附和解吸位点,在热力学上更具优势。原位差分电化学质谱和理论计算表明,晶格氢作为附加的活性位点直接参与了HER过程。因此,β-PdHene气凝胶在10 mA cm-2电流密度下的过电位为20 mV,并具有优异的稳定性,甚至可与商业Pt/C催化剂相媲美。我们的研究为理性设计高活性HER催化剂开辟了一条新途径,突破了传统机制下催化剂设计的局限性。
本文要点
要点1. 提出了晶格氢参与的机理,能够将氢的吸附和脱附位点分开,因此在热力学上比传统反应路径更有优势。通过原位微分电化学质谱表征和理论计算,说明晶格氢能够作为额外的活性位点参与HER反应。
要点2. β-PdHene气溶胶催化剂在电流密度为10 mA cm-2的过电势仅为20 mV,而且具有优异的HER催化稳定性,甚至稳定性可与商用Pt/C比拟。
背景介绍
氢气(H2)被认为是替代传统化石燃料的理想能源,且作为重要的工业原料,因其具有高能量密度和零碳排放,符合全球碳中和的要求。HER被认为是最具吸引力且经济高效的制氢方法之一。Pt基纳米材料被广泛认为是最有效的电催化剂之一。由于Pd基催化剂具有与Pt相似的电子结构且丰度较高,因此成为了潜在的替代品。尽管如此,Pd与H之间的强结合力不利于H2的脱附,导致其HER性能较差。因此,开发高效的HER电催化剂变得至关重要,但这仍然是实现绿色氢经济的挑战之一。在酸性介质中,HER电催化剂的效率很大程度上依赖于催化剂表面H吸附和解吸行为的平衡。根据Sabatier原理,理想的HER电催化剂应具有接近零的氢吸附自由能(ΔGH*)。过强或过弱的H结合能力都会导致活性位点中毒或质子供应不足,从而显著降低HER的反应动力学。因此,开发先进的电催化剂,探索多催化位点,有望突破现有HER机制的瓶颈。
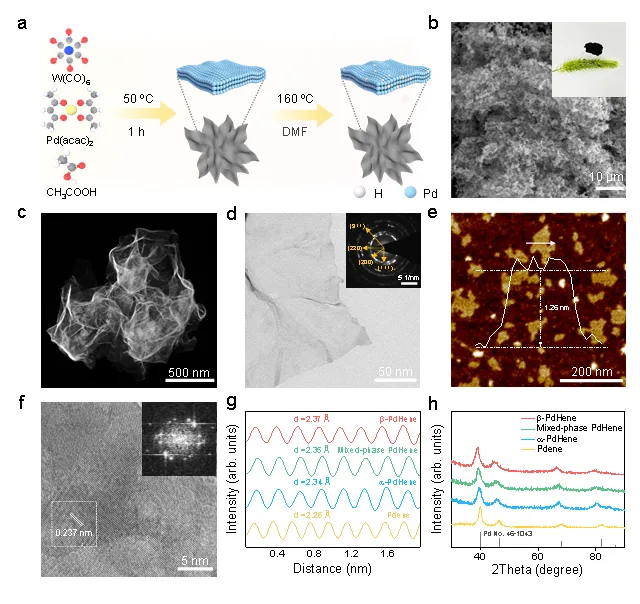
本文采用两步法制备了β-PdHene气凝胶。扫描电子显微镜(SEM)证明了β-PdHene呈现出三维多孔结构。通过高角度环形暗场扫描TEM(HAADF-STEM),透射电子显微镜(TEM)和原子力显微镜(AFM)证明所合成的β-PdHene气凝胶为超薄二维纳米片,厚度约为1.26 nm左右。通过控制反应温度,可以分别获得α-PdHene和混合相PdHene气凝胶。随着反应温度从120 ℃升高至160 ℃,平均晶格间距增大,衍射峰逐渐向低角度移动,表明更多的氢原子被插入到晶格中。
图文解析
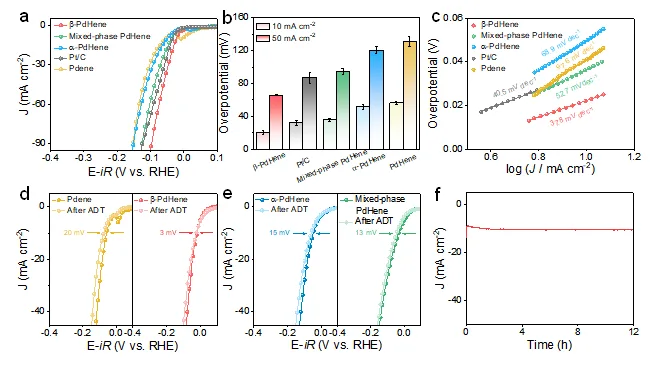
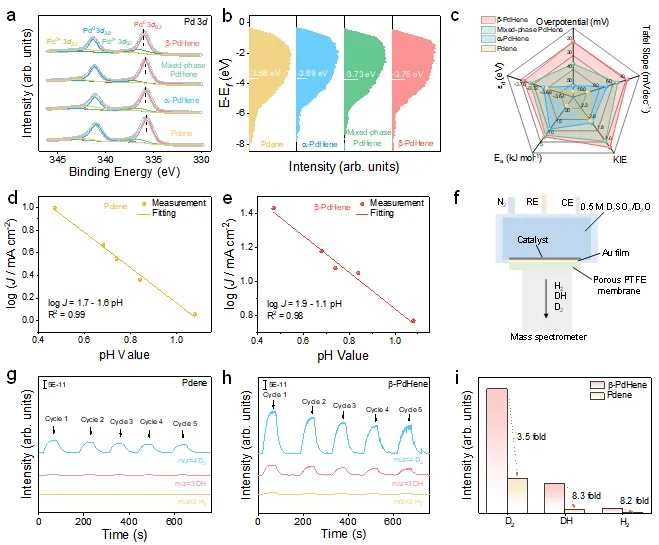
b-PdHene气凝胶在0.5 M H2SO4中表现出最佳的电催化性能,在10 mA cm-2和50 mA cm-2下的过电位分别为20 mV和66 mV,远低于Pdene,a-PdHene,混合相PdHene气凝胶以及商业Pt/C。此外,b-PdHene气凝胶还展示了快速的HER动力学。其电催化HER性能优于近期报道的贵金属基HER电催化剂。同时,加速耐久性实验(ADT)结果表明,在经过5000次CV循环后,b-PdHene气凝胶的催化活性几乎保持不变,稳定性测试后,材料的形貌和结构未发生显著变化。
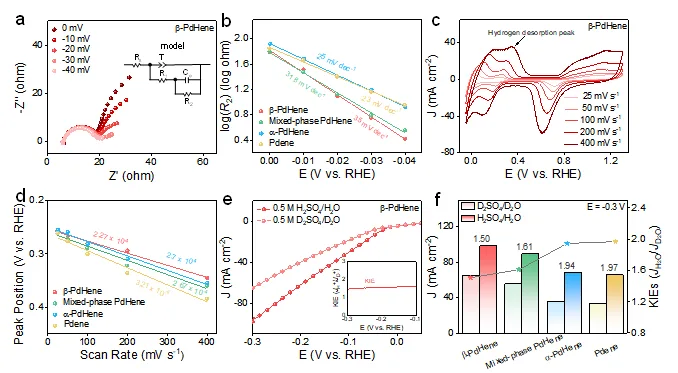
通过原位电化学氢吸脱附动力学、原位电化学阻抗谱以及H/D动力学同位素测试,b-PdHene气凝胶表现出最小的动力学同位素效应(KIE)值,表明其具有较快的氢转移速率。同时,b-PdHene气凝胶的氢吸附动力学有所减弱,而解吸动力学显著增强,这有利于促进H2脱附过程。
X射线光电子能谱(XPS)结果表明,随着更多间隙氢的引入,Pd的轨道结合能发生正移,证明Pd和H之间的电子相互作用增强,从而导致更多的电子转移。通过XPS的价带谱进一步分析d带中心的变化,发现b-PdHene气凝胶的d带中心更远离费米能级,有助于加速了H2脱附。pH依赖性实验表明,b-PdHene气凝胶的反应级数远小于Pdene气凝胶,表明晶格氢参与了反应。随后,原位差分电化学质谱同位素测试提供了更直接的证据,结果显示DH和H2信号的增加明显大于D2信号的增加,进一步证明晶格氢参与到了HER过程。
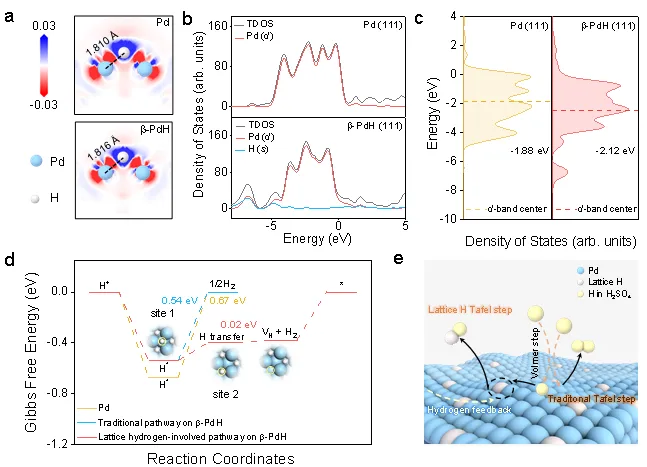
理论计算表明,随着间隙氢的引入,b-PdHene表面的Pd-H键长变长,d带中心下移,减弱了Pd和H*相互作用,促进了H2脱附。同时,晶格氢的参与在热力学上也更为有利。因此,提出晶格氢参与反应机制。在酸性电解液中,质子首先通过Volmer步骤与电子结合形成吸附的H*。随后,两个相邻的H*经过Tafel步骤生成H2,吸附的H*迁移并与相邻的晶格氢结合成H2,这在热力学上更为有利。通过快速的氢转移,氢空位状态得以消除,从而实现整个催化反应的闭环。
总结与展望
总结来说,提出了一种高效的晶格氢参与机制,通过在β-PdHene上分离吸附和脱附位点来增强酸性介质中的HER(氢进化反应)性能,这在能量上比传统反应路径更受青睐。晶格氢参与的直接证据通过原位DEMS实验和理论计算得到了确认。吸附的H*可以迁移并与周围的晶格氢重组,通过Tafel步骤产生H2分子,加速H2的脱附。β-PdHene气凝胶显示出增强的HER活性,在10 mA cm⁻²的电流密度下具有低过电位(20 mV)和显著的长期电催化稳定性。因此,我们的工作提供了一种有前景的方法,通过有利的晶格氢参与反应路径来设计高性能的HER电催化剂。